Мы публикуем стенограмму и видеозапись лекции доктора медицинских наук, зам. главного врача по терапевтической помощи ЦКБ Гражданской авиации, члена правления Московского отделения общества специалистов доказательной медицины Евгения Яковлевича Парнеса прочитанной 27 июня 2013 года. в рамках проекта Публичные лекции «Полит.ру».
Текст лекции:
Спасибо за приглашение! Я начну с того, что скажу, что я преподавал в Медицинском институте около 20 лет. Первый год, когда я ушел из него. И в последние четыре года мне было поручено организовать курс доказательной медицины. Я его организовал, вел. Я для чего это говорю? Я эту информацию готовил для студентов, будущих докторов. Понимаю, что докторов или медиков здесь практически нет, поэтому я сознательно ориентирую эту лекцию не на врачей, а просто на людей, которые что-то хотят знать.
Итак, первый тезис достаточно известен и не подлежит сомнению, - что объем лекарств резко увеличился за последние 50 лет, и удивительно, что изменились многие концепции, практически все концепции в лечении больных.
В качестве примера я приведу книжку, она плохо видна, это 1964 год, книжка называется «Очерки клинической фармакологии» Бориса Евгеньевича Вотчала, замечательная книга, просто советую всем прочитать. Считается, что это был первый клинический фармаколог, то есть специалист по лекарствам, который занимался подходом к лечению конкретными препаратами. Не просто лечению, а разбирался в тонкостях различных препаратов. В качестве объема лекарственной терапии при всех терапевтических заболевания - то, что он описывает, все справа. Надо сказать, что если посмотреть только на то, что относится к сердечной патологии, то это вот этот небольшой раздел. Вы видите, что здесь всего чуть больше 150 страниц.
Сегодняшние тома – только перечисление препаратов занимает тысячи страниц. Изменился объем терапии.
Вот предметный указатель, я взял только одну страницу на развороте, препараты, которые использовались 50 лет назад. Остались подчеркнутые, из них реально, которыми мы пользуемся – может быть, альдактон, димедрол, дигоксин, я еще про него буду говорить, кортизон, гепарин еще остался. Анальгин, но он уже не очень активно используется. А вот этот весь огромный список препаратов - он канул в бездну, он больше не используется.
Отсюда возникает вопрос: а как быть уверенным в том, что новое лечение лучше другого? Почему мы меняем препарат? Может быть, было дешевое, но эффективное лекарство, а вы мне подсовываете, может, не очень эффективное, но жутко дорогое? Может быть, старые препараты были чуть-чуть менее эффективными, но, может быть, у них было меньше побочных эффектов? Среди людей, которые у меня лечатся я выделяю две категории: хороший больной и не очень хороший больной. Хорошего больного, который лечится, интересует цель лечения, за чем надо наблюдать, что делать в той или иной ситуации, он задает эти вопросы себе и врачу. Хороший интересуется, спрашивает, чем его лечат, что он от этого будет иметь. Другая категория больных – не очень хорошие. Они говорят: только не надо мне рассказывать, зачем? Вы мне написали, а я вам полностью доверяю, буду принимать все, как вы сказали. На самом деле, это не очень хорошо, потому что через некоторое время ему кто-нибудь скажет «да зачем вы это все принимаете», и он откажется от этого лечения, потому что несерьезно относится к себе.
Возникают и такие вопросы, как у врача, так и у пациента, на что надо ориентироваться, когда вы лечите? То есть это должен быть какой-то явный эффект, который вы получаете от лекарства, или это какой-то непонятный эффект, который вам гарантируют или обещают, но он будет где-то через 5, через 10 лет постоянного приема, а при этом еще там в аннотации написано, что со стороны печени осложнения. Зачем мне это нужно? Возникает куча вопросов.
Следующий вопрос – как долго можно принимать препарат? Я отвлекусь и скажу, что если медицина середины 20 века – это курсовое лечение, то есть полечили и забросили, то сейчас современная терапия при лечении хронических заболеваний на курсовой эффект вообще не ориентируется. Понятие курсового лечения, классический пример: пациент ложится в стационар, говорит: «Меня полечите, пожалуйста, меня в прошлый раз очень хорошо полечили, покапали капельницы, мне стало хорошо, я целый год ничего не принимал, пока плохо не стало», - вот это называется курсовое лечение. Курс может быть разной протяженности, но он явно ограничен по времени. Он может быть неделю, месяц. Если лечится хроническое заболевание, то, как правило, это не курсовое лечение, это постоянный прием препаратов, за исключением отдельных нюансов, которые я не буду разбирать в этом случае. (Вы потом можете задавать вопросы).
Могут предлагаться разными врачами разные комбинации. Опять возникает вопрос: почему этот врач мне назначил эту комбинацию, а этот – эту? Какая из них лучше, дешевле, надежней? Очень много вопросов возникает.
Еще есть вопросы, которые задаются и врачами, и пациентом, - например, я дал препарат, не помогло, а если к этому препарату я добавлю еще один препарат, который работает примерно в этом же направлении, будет ли лучше? А если два не работают, можно еще третий добавить? Хочется врачу всегда сделать, как лучше, но никто не знает реально, во что это выльется, потому что всегда возникает вопрос. Классический пример - антиагреганты, то есть препараты, которые препятствуют образованию тромбов при ишемической болезни сердца. Классическая терапия – аспирин, надо ли добавить клопидогрель, а если клопидогреля не хватает, то можно ли еще добавить варфарин или новые антикоагулянты? А мы все время думаем о чем? О том, что, с одной стороны, они препятствуют свертыванию, и в результате этого другая сторона вопроса – это повышается риск кровотечения. Вот у врача в связи с этим всегда дилемма. О чем надо больше беспокоиться о риске тромбоза или риске кровотечения. Когда нужно остановиться, чтобы больному было лучше в результате нашей терапии, а не только чтобы тромб не образовывался.
С другой стороны, смотрим на эту же проблему - а почему помогает наша терапия? А потому что есть эффект плацебо у 30% больных. Недавно мне одна пожилая заведующая рассказывала, что такое школа. Шел профессор, за ним шла вся кафедра, все врачи, несли полотенце. Назначали лекарства из того списка, что я показывал раньше, которые все изжили себя, но больному-то становилось легче! И чем больше с профессором народу шло, тем лучше помогало. Понятно, что плацебо-эффект – это очень мощный терапевтический эффект, который надо учитывать в лечении. Особенно это известно, когда появляется новый, еще пока малоизвестный препарат, все его пытаются достать, добывают, отлично помогает, потом проходит время, он появляется в каждой аптеке, и никакого эффекта уже нет. Итак, это эффект плацебо, это пустышка, которая несет настоящий полноценный терапевтический эффект.
Следующее. Многие больные связывают эффективность с тем, что вот я лечился, лечился, лечился, и этим, и этим, наконец-то попал к хорошему доктору, он мне назначил препарат - и у меня все прошло. А почему прошло? А потому что многие заболевания носят волнообразный характер, и так или иначе это заболевание будет длиться определенное время, и просто подошел срок, когда пошла волна на убывание, к этому моменту присоединился новый препарат,а больной и врач считают, что он помог. Но этот же препарат, когда дадут вначале, может уже не работать. Ощущение пациента, что ему очень помог препарат, – тоже не есть истина.
Ну и третье - это то, что действительно разработано очень много лекарственных препаратов, которые уменьшают патологическое воздействие заболевания, способствуют поддержанию ремиссии или выздоровлению, если это острое заболевание.
Следующее, на чем я бы хотел остановиться, - это на прорывах. 19 век – это прорыв в поиске причин инфекционных заболеваний. Это обнаружение микробов, это триада Коха, это развитие учения об эпидемиологии инфекционных заболеваний, это появление учений об асептике, антисептике. Это привело к тому, что смертность от инфекционных заболеваний скатилась ниже четвертого места среди всех причин смертности, и в основном это уже Африка, Азия. Это сейчас уже не становится проблемой, хотя на самом деле, проблемой становится, потому что возникает резистентность микробов к тем антибиотикам, которые замечательно работали в 60-70 годах, но это уже новая проблема. Тем не менее, достаточно большой переворот был сделан в уменьшении инфекционных заболеваний. И я скажу, что главное – это не антибиотики, а прививки. Основной способ избежать тех заболеваний, которые косили население, – это прививки.
Что такое 20 век? 20 век – это выявления факторов риска неинфекционных заболеваний. Перестали люди умирать от инфекционных заболеваний - появились такие заболевания, как ишемическая болезнь сердца, про нее в 19 веке писали, но это были единичные случаи, а в 20 веке это стало эпидемией. Появилась эпидемиология неинфекционных заболеваний, даже был такой институт в Москве (сейчас центр профилактической медицины), и самое главное для нас, что появилось и развилось учение о первичной и вторичной профилактике неинфекционных заболеваний.
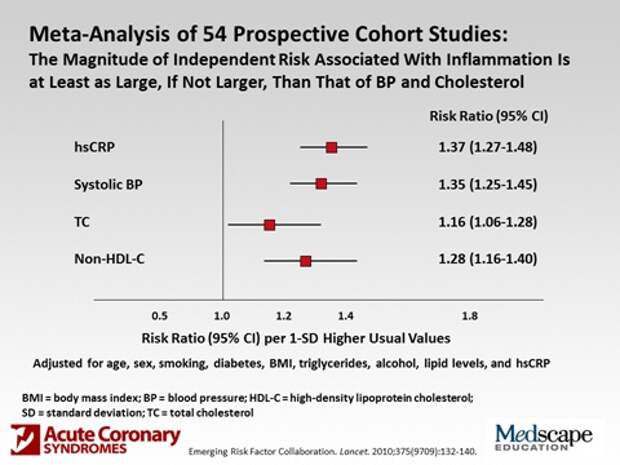
В качестве примера уже результата, как это все выглядит на современном уровне, вот слайд. Это недавно мне прислали, есть такая система Medscape: присылают статьи, можно подписаться врачу, все это присылается ежедневно, можно просматривать всю современную литературу, посвященную медицине. О чем здесь идет речь? Что просчитаны самые главные факторы, определяющие риск сердечно-сосудистых заболеваний. На первом месте здесь стоит воспалительный процесс, то есть высокочувствительный С-реактивный белок. То есть увеличение его всего лишь на одно стандартное отклонение приводит на 37% к увеличению риска смерти от ишемической болезни сердца. Следующее – это систолическое артериальное давление и вредный холестерин, липопротеиды низкой плотности, а не просто холестерин, который у нас обычно определяют. Это просто чтобы показать, во что эпидемиология неинфекционных заболеваний выливается.
Борис Долгин: Вы не ввели понятия насчет факторов первого и второго типа.
Евгений Парнес: Нет, я пока просто сказал, во что выливается эпидемиология. Первичная и вторичная профилактика. Первичная профилактика – это меры, напрвленные на профилактику заболевания, когда у пациента есть факторы риска, но нет еще самого заболевания, например, ишемической болезни сердца. Например, у него есть сахарный диабет, у него артериальная гипертония, но у него еще не было инфаркта. Вторичная профилактика – это меры, направленные предупреждение обострения , прогрессирования заболевания, смерти от заболевания. Например, он уже перенес инфаркт миокарда, но чтобы не было рецидива.
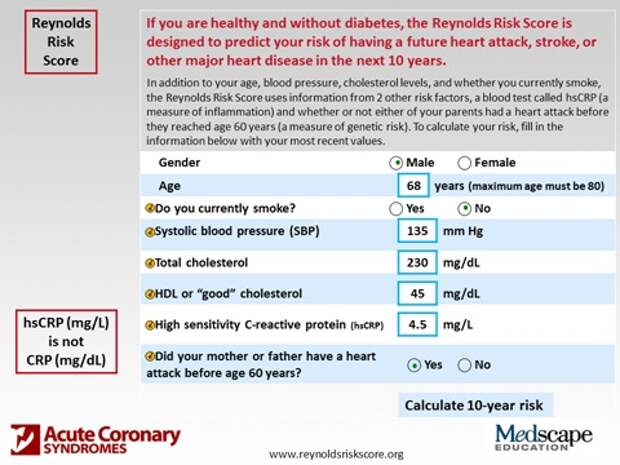
А во что это выливается дальше для врача? В калькуляторы. Каждый пациент, каждый врач может открыть эти калькуляторы, проставить данные, мужчина-женщина, сколько лет, курит – не курит, систолическое давление, уровень холестерина, общего, вредного, высокочувствительный С-реактивный белок, есть ли наследственность, была ли у мамы, папы ишемическая болезнь до 60 лет, и вам дается результат риска события в ближайшие 10 лет.
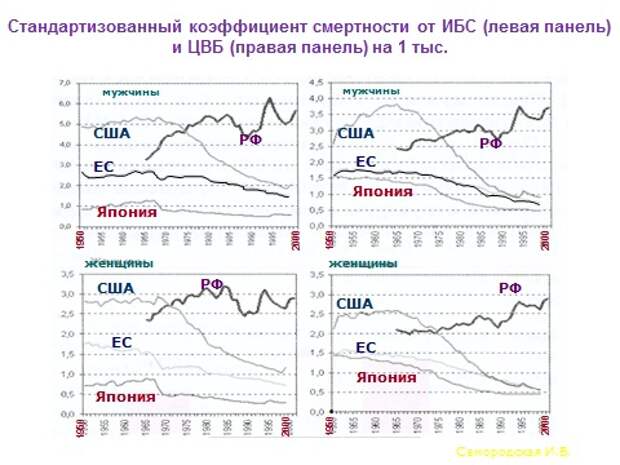
К чему я это все говорю? Давайте это все попробуем понять на этом слайде. Итак, вы видите, наверное, первое, на графике что-то падает. Это называется смертность от ИБС. В США смертность снизилась в 2,5 раза к 2000 году, в России росла. Но нам интересно не это, а то, почему выбрана дата 1950 год? Потому что в 1948 году организовался Институт сердца и легких в США, и началось Фремингемское исследование, то есть начали изучать факторы риска. И вот они изучали несколько лет, около 10 лет, поняли, какие факторы риска есть, они давно известны: это артериальная гипертония, высокий уровень холестерина, малоактивный образ жизни, ожирение и т.д. И стали думать о программах первичной профилактики. Вы видите, что где-то вот здесь стали внедряться государственные программы первичной профилактики. Вы спросите, а в чем эта государственная программа может заключаться? Хотя бы в том, чтобы на пакете с молоком написать, сколько калорий, сколько там жира. Поэтому люди, которые заботятся о своем здоровье, смотрят, чтобы молоко было 0,1-процентное, а не трехпроцентное. То есть, это было внедрение в мозги населения понятий о том, что такое хорошо, и что такое плохо. И вот результат - такое снижение.
Два года назад в Париже был конгресс кардиологов, и был целый симпозиум, посвященный вопросу, что больше снижает смертность от ИБС профилактика или современые методы лечения. Было два спорящих специалиста в области кардиологии. Ответ очевиден: 90% за профилактикой. Естественно, лечение спасает жизнь, но основа лечения – это профилактика. И вот вы видите, что только примерно с 90-х годов пошел резкий спад. С момента осознания проблемы, разработки, внедрения систем профилактики и получения результатов много времени уходит. У нас тоже внедряется, но очень-очень медленно.
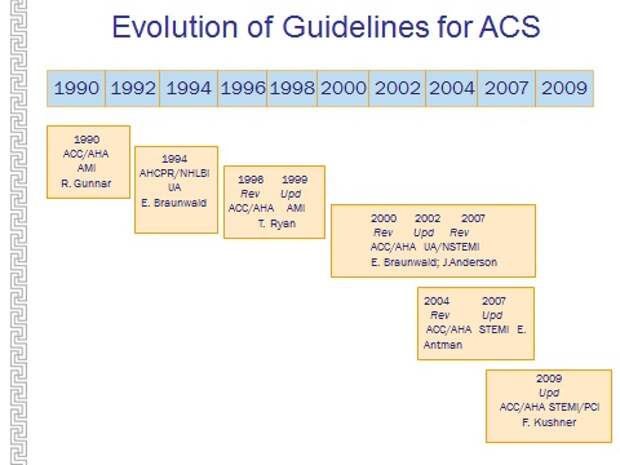
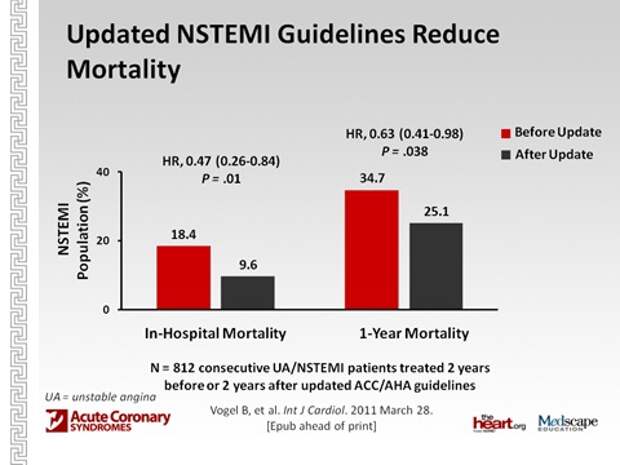
Следующее, что я хотел показать, - что во всем мире проводятся исследования. Эти исследования, если они показывают какие-то значимые результаты, учитываются в рекомендациях, и как только получается какое-то исследование, которое изменяет представление о лечении, то выпускаются новые рекомендации. То есть каждая новая рекомендация – это прорыв в медицине.
Вы видите, что практически каждые два года был какой-то прорыв. Вы скажете: ну, хорошо, вы что-то там меняете, а это к чему-то приводит или не приводит? На самом деле, польза есть от этого?
Вот смотрите, результаты лечения, основанные на рекомендациях 2007 года сравниваются с результатами после изменения рекомендаций в 2009году. Итак, новая тактика приводит к тому, что смертность от инфаркта снижается в 2 раза. И за год, ну, поменьше, но все равно значимо. Получается, что это не просто так - кому-то это выгодней, интересней, - а это доказанные методы лечения, которые целесообразно внедрять.
Теперь я немножко расскажу о предпосылках создания доказательной медицины. Известно, что исследования начинались давно. Если прочитать ту же самую книжку Вотчала, то он и пишет, что «у нас на кафедре проводилось исследование того-то, того-то, и вот мы доказали»… Я хочу сказать, что с 50-х годов идут научные исследования по испытанию препаратов. И это была уже хорошо знакомая всем процедура. Если вы откроете кандидатские, докторские, вы увидите, что большинство из них построено на том, что сравнивался один препарат с другим. Я еще раз повторяю, что идея проведения исследования не нова, она имеет древние корни.
Следующий фактор, который оказал влияние на создание доказательной медицины, очень важный – это клиническая эпидемиология, о которой я уже говорил. То есть научились не только выявлять факторы риска, но и анализировать, какой из факторов риска оказывает большее или меньшее прогностическое значение. Я сразу скажу про последний фактор или предпосылку - конечно, в большой степени это связано с созданием современных компьютерных программ статистического анализа, многофакторного анализа.
Следующее – это Хельсинское соглашение о правах человека. Я говорю об этом, потому что очень часто в быту, среди пациентов, которые иногда ко мне приходят, когда-то, когда я занимался этими исследованиями, все время задавался один и тот же вопрос: «Что, я буду испытуемым кроликом? Вдруг вы мне что-то плохое сделаете?» Ответ: Хельсинское соглашение о правах человека подразумевает, что в исследовании заранее не планируется негативного результата, это исключено. Проверено многократно на животных, на добровольцах, что препарат не вызывает негативных воздействий, может обладать полезным при данном заболевании эффектом.
Борис Долгин: Речь идет о третьей корзине договора ОБСЕ?
Евгений Парнес: Да. Это все прописано. И самое главное, что я хочу сказать, я скажу финал. Если в ходе исследования только появится мысль, подтвержденная статистически, что препарат каким-то образом негативно влияет на человека, это исследование будет прекращено. Права человека защищены. И это очень строго проверяемо. Проверяется FDA на всех этапах проведения исследования, то есть насколько были соблюдены права человека.
Что отличает доказательную медицину от того, что было раньше? А это примерно рубеж 90-х годов. Итак, главное отличие доказательной медицины – это устранить из оценок результата вмешательства препарата человеческую предвзятость. Оказалось, что самый главный фактор, который определяет результат исследования, – эточеловеческая предвзятость, причем исследователь может быть абсолютно честен перед собой, но все равно она работает.
Второе - появились технологии доказательной медицины, которые устраняют ошибки, связанные с правилами проведения исследования. Их называют систематические ошибки, то есть те, которые приводят к неправильным выводам. Это не случайная ошибка, а результат неточной методики исследования, неточных приборов, неправильной статистики. И, соответственно, задача технологии доказательной медицины – максимально исключить систематичсеские ошибки, или перевести их в случайные, чтобы они не оказывали влияние на результаты иследования.
И вот принципиально новое, чего раньше не было вообще, – это ориентация на клинические исходы. Если раньше оценивался эффект препарата в виде того, что человек может ощутить или измерить прибор, то есть клинический эффект: насколько снижает давление, насколько нормализует сахар, насколько снижается головокружение, то есть какие-то ощутимые вещи, которые можно оценить, померить; говорили: «вот отлично, мы даем препарат, он увеличивает фракцию выброса, давайте будем давать всем больным, у которых понижена фракция выброса», - то сейчас эта логика забыта: конечно, препарат не должен делать хуже больному, но главный ориентир – этоулучшение качества жизни и продолжительности жизни, и это ненаступление конечных точек, о которых я потом поговорю. Конечная точка – это то, что необратимо является следствием данного заболевания. В качестве примера - если мы лечим от гипертонии или повышенного уровня холестерина, то главными конечными точками является инфаркт миокарда или смерть. То есть нам главное не просто лечить, а чтобы человек не умер, чтобы у него не развился инфаркт миокарда. Это главное.
На чем построена технология доказательной медицины? Это слепая рандомизация, то есть это отбор в группы сравнения таким образом, чтобы больные в группы распределись так, чтобы группы были совершенно одинаковы. Чем однородней две сравниваемые группы, в которых будет только один фактор анализируемым, тем с больше уверенностью можно утверждать, что изменение, которое мы будем наблюдать в группе исследования, обусловлено фактором воздействия. Если группы совершенно идентичны, мы что-то добавляем, то именно это добавление и оказало тот эффект, который мы регистрируем. Значит, группы должны быть абсолютно идентичны.
Второе – это контроль, в идеале - тройной. Это когда пациент не знает, что принимает, врач не знает, что дает (ну, он догадывается, что он дал одно из двух, но что конкретно, он не знает), и статист, который считает, он тоже не знает. Он знает, что есть препарат А и препарат В, он когда увидит, что эффект одного препарата преобладает над другим, тогда он скажет стоп, отдаст в комитет, а комитет уже будет разбираться, где А, где В. То есть никто ничего не знает до вскрытия кода.
И достаточная величина выборки – это тоже очень важная вещь. Что такое кандидатская диссертация у медиков? 80 больных считаются хорошей группой, при этом там будет 20 здоровых, 60 больных, да еще их поделить на 2-3 группы, то есть по 20 человек в группе. Конечно, какую-то статистическую значимость получить можно, но до настоящей достоверности это совершенно не доходит. Я достаточно тесно связан с биофаком МГУ, хожу иногда, рецензирую всякие диссертации, они делают работы на 6-10 крысах. Это можно делать, потому что совершенно однородная генетика, однородное питание, содержание крысы, там настолько все однородно, что можно утверждать, что полученный результат в какой-то степени обусловлен тем или иным воздействием. Приведу обратный пример - когда я был рецензентом кандидатской диссертации по поводу сердечной недостаточности, в одной группе был один человек, в другой три, где-то было 5. Максимально было 14. Я просто говорю о том, что защититься можно, но это работа…
Итак, первое, самое главное для рандомизации – это случайность отбора в группы рандомизации. Рандомизация – это процедура, направленная на обеспечение пациентам равных шансов получения исследования препарата. Минимизирует различия между группами, создает условия корректного использования статистических тестов на достоверность, ну и это создает как раз стандарт качества исследования препарата.
Рандомизация включает два этапа. В исследование не включаются все попавшиеся больные с данной нозологией, это достаточно сложный скрининг (отбор) сначала. Человек приходит с данным заболеванием, скажем, с бронхиальной астмой, дальше смотрят, на каких он препаратах, если он на этом, исключается, если у него есть обострения, исключается, если у него давно не было обострений, исключается. Есть определенный отбор тех параметров, которые нужны для включения больного в данное исследование, это называется критерии включения. Кроме того, есть критерии исключения. Скажем, он по всем параметрам подходит, но у него показатели печени не в порядке, - он будет исключен. Когда, наконец-то, сформировали более или менее однородную группу, которая подходит под критерии включения в данное исследование, и у которых отсуствуют критерии исключения, проводится процедура рандомизации. Обычно электронная, вы просто набираете номер, говорите возраст, пол, и, в общем, на этом все, и вам присылается номер пациента. Номер пациента будет определять назначение ему того или иного препарата. Вы никак повлиять на выбор препарата у конкретного пациента не можете.
В качестве примера - вот неплохое исследование, посвященное тому, надо ли добавлять клопидогрель к аспирину для того, чтобы предотвратить инфаркт миокарда у больного, который уже имеет ишемическую болезнь сердца стабильного течения. Здесь 3200 где-то человек включено. Моя задача какая? Показать, что дает случайный разброс данных. По куче признаков, по которым сопоставлялись эти больные, цифры практически одни и те же. Это случайность! Только теория вероятности может позволить так равномерно разбросить пациентов, чтобы все признаки были совершенно идентичны. Это меня просто покорило, смотрите атеросклероз периферических артерий 1418, 1420. Кстати исследование провалилось, оно показало, что разницы никакой нет, то есть больным со стабильным течением ИБС добавление клопидогреля бессмысленно к аспирину.
Видите, по каким признакам это исследование учитывалось при рандомизации? Это же ведь пример современного исследования, а они проводятся на всех континентах, поэтому учитываются раса, пол, возраст, куча сопутствующих заболеваний, препаратов, все это учитывается при рандомизации и анализе исследования. Вы спросили меня, какое количество народу включается, я там ошибся, 15 000. Этонормальное исследование. Недавно исследования я помню по предотвращению тромбоза на фоне мерцательной аритмии, там порядка 20 тысяч. То есть это явно не 20 человек.
Классическое – это тройное.
Конечно, слепой контроль устраняет систематическую ошибку субъективной оценки препарата. Представьте себе, врач сравнивает пустышку и бета-блокатор. Он знает, что от бета-блокатора при ишемической болезни должна быть польза, он так учился. И он видит, что у больного не снижается пульс, он же хочет как-то помочь. Поэтому он каким-то образом будет что-то видоизменять и корректировать терапию больного. Вы должны понять, что врач не автомат, он живой человек, и его основная задача – помочь человеку, которых в данных исследованиях иногда наблюдают 5-7 лет. Это не просто так - пришел, дал и ушел. И второе, слепой контроль, это тоже сюда относится, очень важный момент, чем объективней метод оценки величины изучаемого эффекта, тем меньше необходимость в ослеплении НРЗБ.
Наиболее важное – это смерть, когда трудно соврать, хотя все равно врут: можно скрыть. Но, чтобы интерес немножко поднять, что значит «скрыть»? Врач может не знать, может не связываться, потому что это огромное количество документации, в которую на 3-4 месяца погружаются для того, чтобы отписаться. Поэтому как бы потерялся, уехал куда-то и как бы потерялся, я не знаю судьбу этого пациента. Фирмы нанимают частных детективов для того, чтобы найти тех, кто выбыл, потому что если в исследовании большое количество потерявшихся больных, то это очень большой минус этому исследованию. То есть это очень серьезная вещь, и их, потерявшихся добывают, то есть сама фирма, которая занимается апробацией препарата, заинтересована в том, чтобы этих вещей не было, потому что потерявшийся приравнивается к негативному результату.
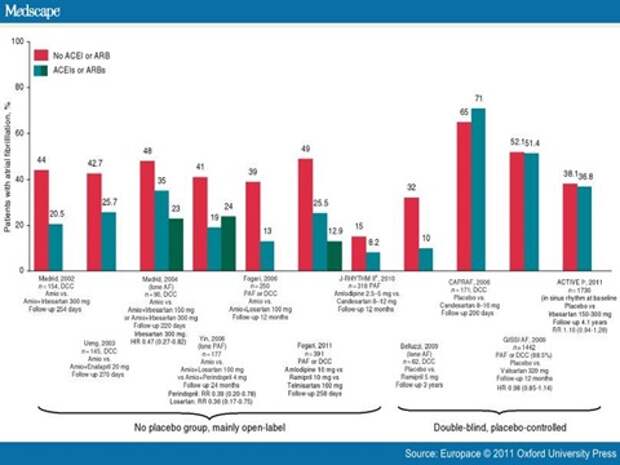
А вот теперь немножко о предвзятости. Итак, слайд, полученный от Medscape, говорит о том, что была идея, что если давать препараты, это ингибиторы ангиотензинпревращающего фермента, препарат, используемый для лечения артериальной гипертонии или для лечения сердечной недостаточности, или на замену пришедшие ему ингибиторы рецепторов ангиотензина-2, это препараты, подавляющие механизмы повышения давления, задержки жидкости, я грубо скажу. Была идея, что если мы эти патологические механизмы будем подавлять, то не будет мерцательной аритмии, не будет она развиваться. Смотрите, какие замечательные результаты. Огромная разница: здесь не давали - а здесь давали. Вы видите целую серию исследований, которые показывают, что лечите, пожалуйста, доктора, только так, а не иначе. Только обращаю ваше внимание, что не было плацебо-контроля, и что они были открытые. То есть доктор знал кому, какой препарат дает. Докторские, кандидатские. Ну так, я подсказываю. А теперь смотрите, вот оно стало двойное слепое и плацебо-контролируемое, все те же препараты,и опять отличный результат. Смотрим, сколько народу было включено, 62. А когда результаты здесь сравнялись? Когда стало много больных в исследовании - 1400 здесь, 1700 здесь. Это о чем говорит? О важности количества включенных в исследование. Если мало, вы получили опять хороший результат. Когда пошли настоящие группы исследования,никакого эффекта нет.
О чем разговор идет? О двух идеях: хорошее исследование должно быть ослеплено, должно быть сравнительное или плацебо-контролируемое, и выполняться на больших группах.
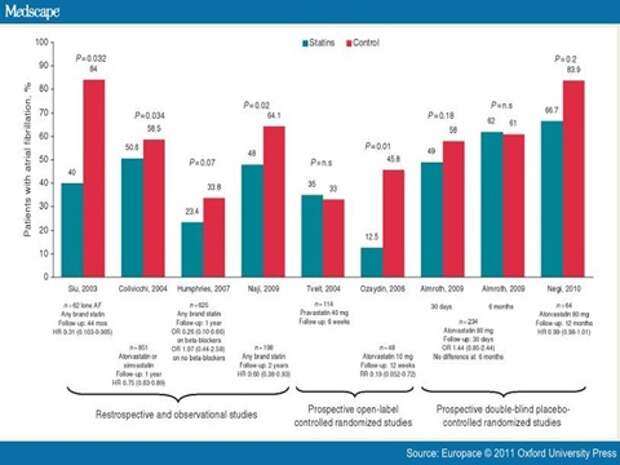
Еще одна идея, если будем давать статины, будет ли это предотвращать мерцательную аритмию? Такие работы на слайде были подобраны. Мы смотрим, опять отлично работают статины, то есть там, где статины есть, пароксизмов мерцания нет; там, где контроль, - все плохо. Что это за исследование? Это, оказывается, ретроспективное исследование, или обсервационное. Обсервационное - это вот когда ко мне ходит много народу, и всякие препараты принимает. Я говорю, вот этот статины принимает – ему помогает, а этот не принимает – и ему плохо. Делаю вывод: статины – отличный препарат. Это наши докторские и кандидатские диссертации. Есть ещеретроспективные исследования - это когда ко мне в стационар попал уже пациент, скажем, с инфарктом миокарда, и я начинаю ковыряться в его истории: какие факторы риска, курил, не курил, принимал, не принимал, я смотрю его старую историю, и потом сопоставляю результат, и говорю, влияли ли эти факторы. В одном исследовании статины работали, в другом не работали.
А вот это правильное исследование, проспективное. Это когда я отобрал однородную группу, которую я разбил пополам, рандомизировал, одной назначил препарат, другой не назначил, и буду на протяжении 5-7 лет смотреть, что будет происходить. Вот тогда это более или менее надежно. Что мы видим – что все эти проспективные исследования говорят о том, что статины не работают.
Хорошее исследование – то, которое проспективно, которое задумано заранее, отобраны люди заранее, и дан препарат заранее, до наступления конечных точек, и конечные точки потом просчитываются.
Мы говорили еще о достаточной величине выборки. Я говорил, что хорошие исследования - это всегда больше 1000. Лучше – когда 5000. Сейчас даже до 30 000 доходят, когда трудно доказать эффект, проблемно.
Что еще хотел сказать? Что такие исследования невозможно сделать одному врачу, поэтому это всегда многоцентровые исследования, то есть их делают в нескольких клиниках одного города, в нескольких городах одной страны, в нескольких странах одного континента, и практически на всех континентах. Цель такая - чтобы попали испытуемые с разной генетикой, с разными особенностями питания, образа жизни, температурного режима. Анализируется все. С одной стороны, это одна задача многоцентрового исследования, а вторая задача – это выбить плохой сайт.
Сайт – это группа врачей, которая занимается исследованием препарата. Если они работают плохо, скажем, подтасовывают результаты, такое бывает, потому что исследования стоят достаточно дорого, то этот сайт потом будет легко вычленен с помощью статистики - что такой-то сайт работал неправильно. Если доля больных, которых включил этот сайт, будет очень большая, больше 5%, то он может уже оказывать влияние на результаты всего исследования. Если вклад сайта сделать ближе к 1 проценту, то его негативное влияние устраняется переводом уже в статистическую ошибку. Выкинуть результаты плохого сайта нельзя, даже если вы доказали, что он плохо работал. Больные в ислледовании все равно учитываться будут. А вот сайт попадет в черный список, и больше ему не дадут исследования. Поэтому возможность такой систематической ошибки устраняется с помощью технологии доказательной медицины, еще раз говорю, не более 20 пациентов в одном сайте. Если в исследование включено 20 тысяч, то это не страшно.
Итак, вот современный дизайн клинического исследования третьей фазы. Первая фаза делается на добровольцах - проверяется, как всасывается препарат, как распространяется, как выделяется. Это платное исследование, есть специальные люди, которые зарабатывают деньги тем, что пишут информированное согласие, что они согласны на проведение испытаний на них лекарственных препаратах. Они здоровые, лежат в клиниках, и на них проводят эти исследования. Вторая фаза – это очень тщательно отобранные больные, у которых нет никаких сопутствующих заболеваний, с очень четкой клиникой по основному заболеванию, по поводу которого назначается новый препарат. Скажем, ревматоидный артрит, хотят узнать новый препарат для лечения ревматоидного артрита. Но тогда, чтобы у больного не было ни гипертонии, ни ишемической болезни сердца, чтобы ничего у него не было, кроме одного ревматоидного артрита, причем на определенной стадии. Очень строгая группа, чтобы посмотреть вообще, работает или не работает препарат, в какой дозе работает препарат. Это стадия, где устанавливается лечебная доза. Больным даются разные дозы, находится та доза, которая эффективна. Третья стадия – это когда найдена доза, набирается уже огромное количество народа, которому дается найденная доза, и проверяется, работает ли она. Четвертая стадия – препарат уже в аптеках, после третьей фазы разрешается регистрировать препарат, он появляется в аптеках, но все равно врачи продолжают исследовать, они имеют право писать свои отзывы на препараты, иногда это просто постмаркетинговое исследование, в России очень много постмаркетинговых исследований по кардиологии четвертой фазы.
Конечные точки – это очень важно, потому что это часть разговора с пациентом, когда он говорит, почему вы это мне не даете, или - почему вы это мне даете, и я пытаюсь ему объяснить, зачем я это делаю. Итак, твердые конечные точки – это клинически значимые данные, это продолжительность жизни, смертность, частота развития патологии, и мягкие, что было раньше, суррогатные их называют, это физикальные и лабораторные данные, то есть снижение уровня давления, снижение объема форсированного выдоха при бронхиальной астме, уровень гликемии, уровень глюкозы в крови при сахарном диабете. Еще раз повторю, что цель исследования – это влияние не на суррогатные точки, а предупреждение наступления твердых.
И вот обаяние суррогатных исходов. Показываю на пальцах. Было очень много антиаритмических препаратов. Больной приходит и говорит: меня беспокоит нарушение ритма, мне плохо, есть препарат, который бы мне помог? Доктор думает, вот смотрите, у него инфаркт миокарда, при этом возникло нарушение ритма, мне надо бы дать препарат, который бы это нарушение ритма убрал, потому что у тех, у кого нарушение ритма есть, повышен риск смерти. Логика очевидна. Значит, надо дать препарат, который убирает экстрасистолию. Было исследование CAST, дали препарат больным с инфарктом миокарда, у которых возникла желудочковая экстрасистолия, результат – они начали умирать больше, чем те, которым не давали. Вывод – испытываемый антиаритмический препарат при ИБС запрещен. Но попробовали на другом препарате, думали, что если тот неправильный препарат, то есть другие, лучше. Эффект такой же. Поэтому группа 1С, 1А запрещены для использования у больных ишемической болезнью сердца. Само нарушение ритма - да, неприятно, но оно меньше определяет летальный исход, чем назначение хорошего, казалось бы, препарата.
Следующее. Сердечная недостаточность, я помню американские журналы конца 90-х годов, где реклама была, первые 10 страниц: милринон - это потрясающий препарат, повышает фракцию выброса, то есть сокращение сердца при сердечной недостаточности на 20-30 процентов, лучше не бывает. До сих пор сейчас всем на всех симпозиумах показывают, что на милриноне у больных ИБС смертность больше, чем если без него. Короткий эффект хороший, помогает больному, ему становится лучше дышать, но смертность, если посмотреть всю группу, оказывается больше. Все, закрыта тема.
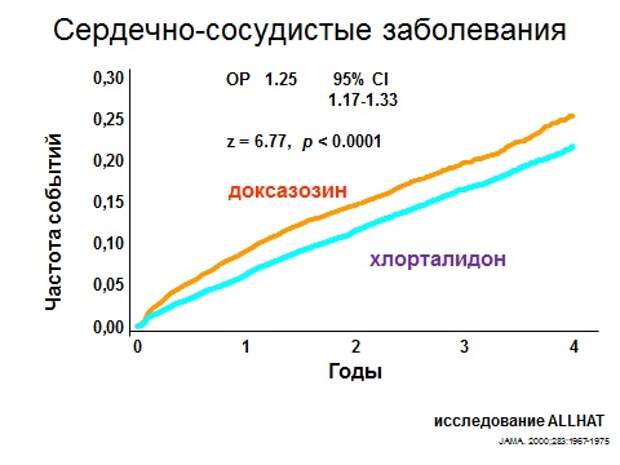
И совсем уже очевидный вопрос - почему я его вставил? Потому что недавно ко мне пациент пришел и сказал: мне тут кардиолог назначил этот препарат дальфаз для снижения артериального давления. Давайте я вам покажу, итак, артериальная гипертония, альфа-адреноблокаторы, очень мощный препарат для снижения уровня артериального давления. Прекрасно снижает. Препарат доксазозин, его аналог, он используется сейчас уже преимуществено урологами при нарушении мочеиспускания у мужчин – сфинктер расслабляет, и поэтому облегчает. Смотрите, исследование ALLHAT, достаточно крупное исследование. В чем была цель? Добиться разными группами препаратов одного и того же значения давления, то есть по уровню давления все стало одинаково. Все сделали, они достигли какого-то уровня. Но вы видите, что количество случаев, событий сердечно-сосудистых, то есть инфаркт, инсульт, было в группе доксозазина на 25% больше, чем в группе простого дешевого мочегонного. Исследование доксазазина тут же закрыли, то есть этим больным его прекратили давать, просто анализировали их дальнейшие результаты.
Вывод из этого исследования – доксазозин просто так больным от гипертонии не давать. Давление снижает замечательно, но цель-то у нас не снизить давление, а жить, - и хорошо, и чтобы не было инфаркта. Поэтому еще раз говорю: конечные точки намного важнее, чем суррогатные точки, это вывод этого слайда.
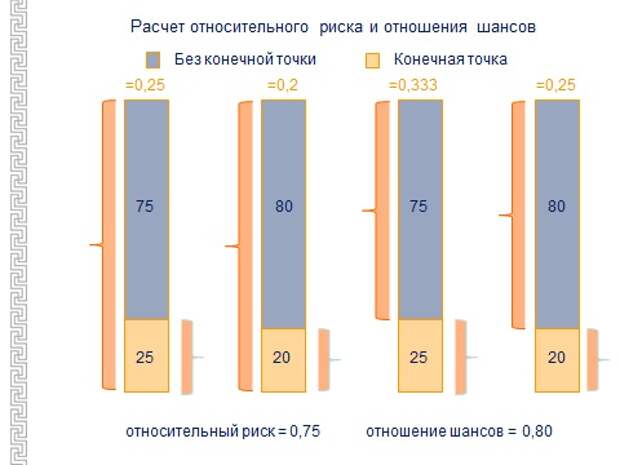
Теперь немножко про то, что я вам показывал, - RR, OR. Есть относительный риск и отношение шансов. Чем они отличаются друг от друга?
Здесь я попробовал представить в виде столбиков диаграммы, чем отличается относительный риск от отношения шансов. Относительный риск – это при испытании лекарственных препаратов, когда группы не очень большие, когда смотрится количество нежелательных событий, которые возникли, в ходе исследования, ко всем включенным пациентам в данной группе. То есть устанавливается риск какого-либо события в результате лечения на одном препарате, и на другом препарате, и потом сравнивают эти риски между собой в виде отношения. А если это эпидемиологическое исследование, то смотрят количество событий у тех, у которых есть фактор риска, скажем, курение, к тем, у которых нет фактора риска. То есть здесь ко всем включенным отношение, а здесь к подгруппам: одна с наличием фактора риска, а другая - без. Я потом буду много показывать каких-то интересных фактов, как к этому надо относиться?
Если OR или RR равно 1, значит, никакого влияния не оказывает ни препарат, ни фактор внешнего воздействия. Если он меньше 1, то влияние в положительную сторону, значит, лекарство уменьшает количество серьезных осложнений. Если больше единицы, это значит, риск каких-то нежелательных явлений возрастает.
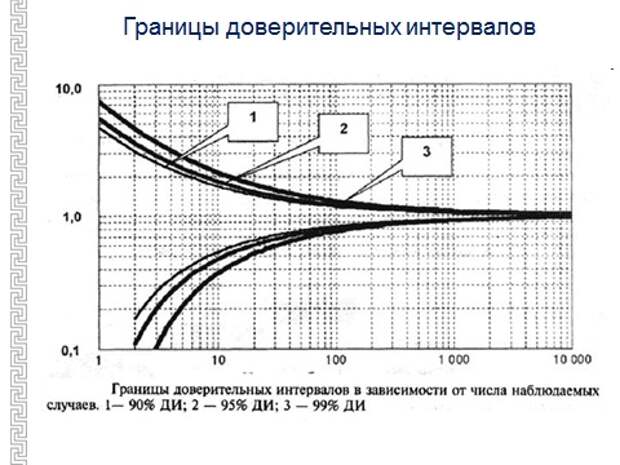
Еще очень важная вещь, которая нужна для понимания результатов исследования, – это доверительный интервал. Надо понимать, что после включения примерно 100 пациентов уже и 90% и 99% доверительные интервалы почти сливаются, как вы здесь видите, и, на самом деле, в большинстве иследований принят 95%-й доверительный интервал. Когда проводятся испытания лекарственных препаратов, ориентируются не на индивидуума, а на группу пациентов. То есть представляется, что если препарат помогает, то он должен помочь 95% пациентов, которым мы назначили лечение. Могут быть маргиналы, 5%, которым не помогло за счет их индивидуальных особенностей. То есть эти клинические исследования ориентируются на массу, на усредненные представления о человеке.
Теперь следующее: соотношение относительных рисков и доверительные интервалы. Это метаанализ (см слайд), но я его показываю с другой точки зрения - с точки зрения того, сколько времени потребовалось для того, чтобы метод внедрился в практику, и какое количество больных нужно было пролечить, чтобы быть уверенным, что он работает. Вы, наверное, слышали, что в Советском Союзе впервые применили в 60 году внутрикоронарный тромболизис. Инфаркт миокарда – это следствие образования тромба в месте разорвавшейся бляшки коронарной артерии. И если подвести, как было сделано, в Институте кардиологии группой исследователей, фибринолизин, тогда был такой препарат, который растворял тромб, к месту, где находится тромб, то он растворяется, и инфаркт миокарда был меньших размеров и протекал с меньшим количеством тяжелых осложнений. Они написали «50% больных помогает»,так как относительный риск был 0,5. Но количество больных, включенных в исследование, было 29, поэтому доверительный интервал очень большой, и чтобы вам было понятно, видите, этот доверительный интервал пересекает единицу? Если он пересекает единицу, значит, результаты исследования не достоверны. Результат есть, он хороший, но мы этому не верим. Повторили исследование, общая сумма 65 больных, опять отличный результат, 50%, меньше доверительный интервал, но все равно пересекает единицу. За рубежом тоже стали тромболизис делать всем подряд, получилось 10% польза, и абсолютно не верим. Точка – это и есть относительный риск, то есть насколько лечение сдвинуло результат в положительную сторону от единицы. Если в эту сторону – хуже, в эту лучше. Еще крупное исследование, уже 1500 народу, где-то 25% пользы, но все равно пересекает единицу, значит, опять не верим.
А что это были за исследования, почему такой большой разброс? Конечно, это был период понимания того, в какие сроки можно проводить, с каким конкретным инфарктом миокарда можно проводить, то есть формировалось представление о том, кому это полезно, кому это можно, а кому это не нужно и даже вредно. Когда сформировались эти представления и стали проводиться исследования уже с определенными критериями включения и исключения, и вы видите, что еще 2500 человек включено, и вот впервые 25%, доверительный интервал не пересекает 1. Р меньше 0,01, это говорит о том, что если вы будете проводить тромболизис 100 пациентам, то положительный эффект от него у 99- не будет случайностью. Случайность того, что препарат не работал, но получен положительный эффект, составляет один процент. Вот как перевести эту циферку. Большинству, то есть 99% пациентов это лечение поможет. Дальше вы видите увеличение количества больных, включенных в подобные исследования, 48000, и вы видите, что здесь уже абсолютная достоверность, и это давно уже принятый метод к лечению во всех странах.
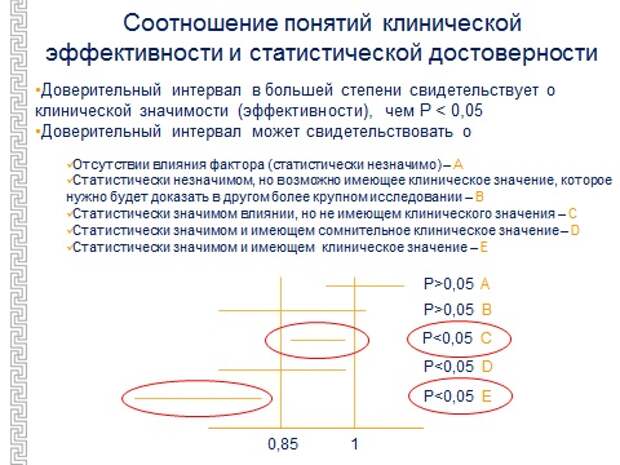
Еще есть некоторые ловушки маленькие, скорее, эти ловушки для врачей, чем для пациента, но все-таки ловушка существует, когда говорят, что препарат работает, так как статистическая значимость есть, а есть ли клиническая эффективность? Можно разделить эти два понятия: статистически достоверно, а клинически - нет. Давайте посмотрим на таблицу, как это выглядит. Здесь мы видим, препарат вообще не работает, это очевидно, вот единица, здесь тоже не работает, потому что пересекает единицу, но этот препарат, если увеличить группу наблюдения, может быть, и заработает, потому что доверительный интервал сожмется, и тогда это будет означать, что эффект не случаен. А вот этот, видно, Р меньше 0,05, что статистически влияние препарата есть, а клинически это практически неэффективно. Это будет лучше на какие-то 7%, то есть клинический эффект препарата ничтожен. Надо столько пролечить людей, чтобы помочь одному, что это лечение практически нецелесообразно. Он статистически прошел, помогает, но его клинический эффект ничтожен. Следующее – помог, но слабо, и вот это отлично работающий препарат, то есть он смещен резко за 0,85. 0,85 – это водораздел, где хорошо работает препарат или не очень.
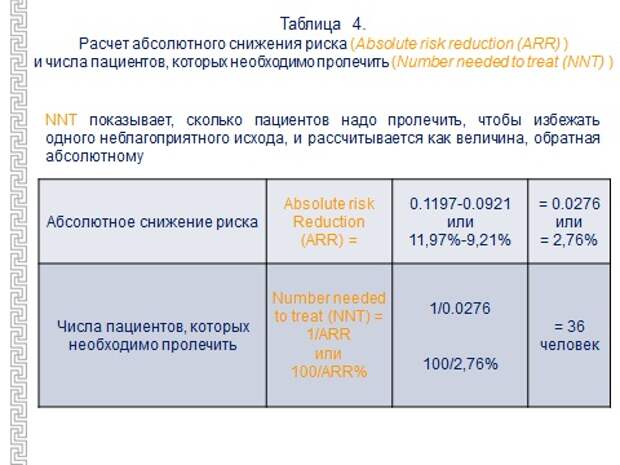
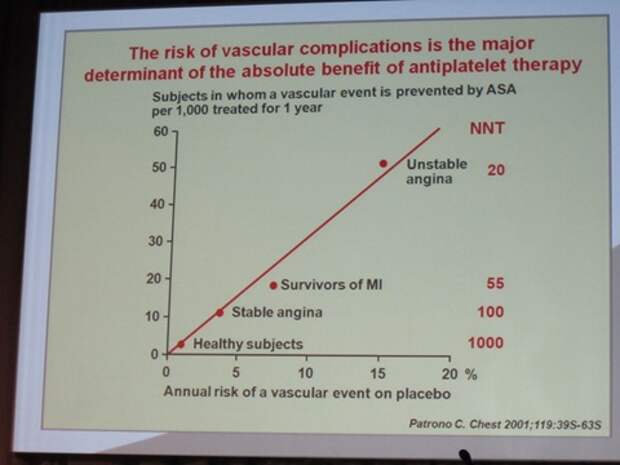
Ну, чтобы немножко еще пояснить, - может быть, я в дебри ухожу, но это достаточно важные вещи для понимания того, что с вами делают. Есть такое понятие, как количество пациентов, которых нужно пролечить, чтобы спасти одного от конкретного нежелательного явления, скажем, от инфаркта миокарда, смерти, от инсульта и т.д. Получается этот показатель таким образом. Находится абсолютная разница в наступлении рисках конечной точки в двух сравниваемых группах. Затем 100% делится на эту абсолютную разницу в рисках.
Давайте я просто приведу пример оценки показателя количество пациентов, которых надо пролечить, на этой схеме. К вопросу об аспирине, аспирин полезен, мы все знаем, что прием аспирина предотвращает инфаркт миокарда и смерть от ишемической болезни сердца. А кому больше всего помогает? Тем, которые поступили с нестабильной стенокардией. Надо пролечить 20 больных, чтобы спасти одного. А если больной с инфарктом миокарда, то 55, а если у него стабильная стенокардия, то 100, а если он здоров, но есть только факторы риска – 1000. Целесообразно ли лечить аспирином людей с факторами риска,но без явного сердечно-сосудистого заболевания, возникает вопрос. Эффективность становится сомнительной, особенно для женщин. Думали, что для всех больных прием аспирина – это хорошо, а оказалось, что хорошо работает при острых состояниях. А вот когда женщины думают, вдруг у меня будет инфаркт, инсульт, и с 50 лет начинают пить аспирин, то - не надо, язва возможно будет, а спасти – скорее не спасете. Одной из тысячи поможет, в год. Я потом приведу это исследование родное, откуда эти цифры взяты, и там будет риск кровотечения, вы поймете, что там баш на баш. Это и есть то количество, которое называется number needed to treat, то есть количество больных, которых надо пролечить, чтобы предотвратить определенное нежелательное событие. Этот показатель говорит об эффективности не только препарата, но и ситуации, при которой вы назначаете данный препарат.
Есть так называемые систематические обзоры, где подводятся итоги многих работ; в чем его преимущества? Там выбрасываются плохие работы, и остаются хорошие. Авторы этих обзоров перечисляют хорошие работы и пишут, почему выбросили плохие.
Что такое метаанализ? Это тоже вариант обзора, но только это сопрвождается дополнительным статистическим обсчетом результатов, суммы всех исследований, которые были включены в этот обзор.
Давайте я покажу это на примере. Смотрим, препараты кальция для профилактики остеопороза. «Кушайте все препараты кальция». А другие доктора смотрят, а не принесет ли это вреда с точки зрения инфаркта миокарда. Да, чуть-чуть смещается вправо, вред есть, но он ничтожен. Посмотрите доверительный интервал, видите, везде пересекает единицу? Но наконец-то нашелся человек, который объединил все эти исследования, и вот результат, на 24% повышается риск инфаркта миокарда, и это достоверно. Вывод – не надо пить просто так препараты кальция. Пейте витамин D. У меня сейчас нет задачи рассказывать, чем лечиться. Я говорю о том, что методы доказательной медицины переворачивают наше представление о том, что мы можем делать, а что не можем делать.
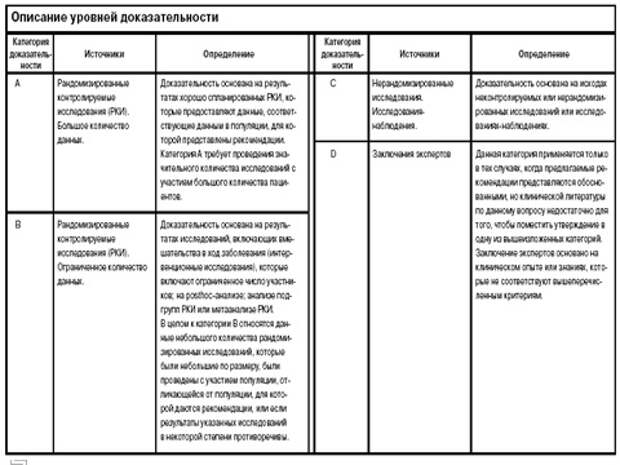
Во что все эти исследования выливаются? Вот в такие рекомендации, которые заканчиваются тем, насколько эти рекомендации доказаны. Есть 5 уровней доказательности, но обычно классифицируют их в 4, а в кардиологии – в 3 уровня доказательности, то есть насколько нам этому надо доверять? Коротко так: если много крупных исследований, при этом с одним и тем же результатом, то уровень доказательности А, это абсолютно доказанная вещь. Если это одно крупное, или несколько достаточно мелких, но с одинаковым результатом, то это уровень В. А если это наши докторские и кандидатские, то это уровень С. А если «Я так думаю», то это уровень D. Верим этому (уровень А), а к этому (уровень С) можем и так, и так относиться, по-разному. Как это отражается в таблицах? Есть еще другие таблицы с определением уровня доказательности, например, в кардиологии принято всего три уровня, вот они, уровни А, В, С.
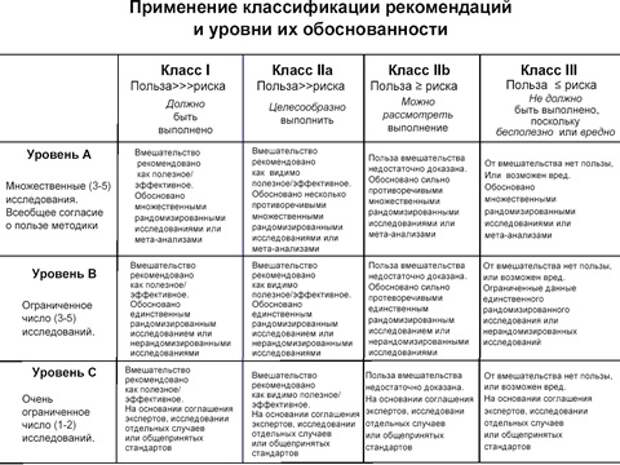
В рекомендациях также присваивается класс виду лечения. Что же отражает класс? Мы всегда понимаем, когда говорим о лекарстве, что у него есть побочные эффекты. Да и пациент приходит и спрашивает: «Вон сколько, там всяких побочных эффектов! Как же вы мне это назначаете?» Ответ, а потому что я соотношу пользу с риском вреда. Где это отражается? В классах. Если польза существенно выше риска, то это класс 1. Если польза выше риска, то это класс 2, это тоже надо назначать, в любом случае. И вот 3 – помните, я вам рассказывал, исследование CAST, там, где антиаритмики? - это запрещено, вред может быть больше пользы, никто не должен назначать препарат, вид лечения, который относится к третьему классу. В рекомендациях будет написано: такой-то препарат, класс 3, уровень доказательства А.
Я всегда студентов спрашивал, это этично или неэтично, что препарат классифицируется как класс 3, но уровень А. Ведь это значит, что несколько крупных исследований доказало, что он вреден. Это этично или не этично? Неэтично? Еще есть мнения? Смотрите, был препарат, который давали по поводу нарушения ритма. Потом провели исследования, доказали, что он вреден, потом провели еще одно исследование с другим препаратом, опять доказали, что он вреден. 2 крупных исследования говорят о том, что этот препарат использовать нельзя. Получается, что было включено 3 или 5 тысяч человек в эти исследования, были подвергнуты риску тому, чтобы им стало хуже. Я задаю вопрос, это этично или нет? Этично. Так как до этих исследований больных этими препаратами лечили, думая, что помогают больному, а в ходе исследования выяснилось, что использовать их при подобных ситуациях нельзя. Вот если вы будете давать после этих исследований препарат по тем же показаниям, которые были в исследованиях – это неэтично и ужасно, это подсудно даже. Эти препараты (антиаримики) используются у ряда категорий больных (без ИБС), которым он хорошо помогает. Моя сейчас задача – показать, о чем думает доктор, когда назначает тот или иной препарат, как он его классифицирует, как классифицирует тот или иной метод воздействия.
Следующий вопрос. Вот американские рекомендации по кардиологии, красный цвет говорит: стоп, остановись, не назначай (класс 3), зеленый – назначай (класс 1). Они просто красочно даны, у нас не дают так красочно, как американцы или европейцы, но по сути одинаковы.
И вот вам пример рекомендаций по оказанию помощи больным с инфарктом миокарда. Они говорят, как относиться к ранней инвазивной стратегии при инфаркте миокарда, что надо делать? Надо идти на стентирование. Уровень доказательства А, класс 1, то есть во всех исследованиях доказано, что это абсолютно полезно. Вот это и есть руководство к действию, доктор смотрит на это, и абсолютно уверен в том, что он должен это делать. А если ему будет написано, уровень доказательства А, а здесь будет стоять 3 (класс 3), то будет красный свет. То есть такой способ лечения обсуждается, но не дай Бог, что ты его будешь использовать.
Теперь я немножко скажу, для чего я выступаю. Помимо того, что я рассказываю вам, что такое доказательная медицина, из чего она состоит, на что направлена, я хочу сказать, что я люблю работу с продвинутыми пациентами. Я скажу с другой стороны, сейчас: мне достаточно неэтично каждый раз говорить, вы знаете, вам назначили воду, вы прошли курс непонятно чего и т.д. Поэтому, мне сейчас достаточно просто сказать: знаете, я скажу вам ресурс, вы туда зайдите, откройте и посмотрите, там все хорошо написано. Я к чему сейчас склоняюсь… Я хочу сказать, что мы живем в достаточно циничном мире и мы зачастую не знаем, кому доверять, насколько можно доверять, доверяет ли врач сам своим методам лечения, доверяем ли мы врачу с его методами, как вообще с этим всем работать, как вообще жить?
И вот одно из исследований COURAGE, которое уже давно всем крутит голову, давайте я расскажу.
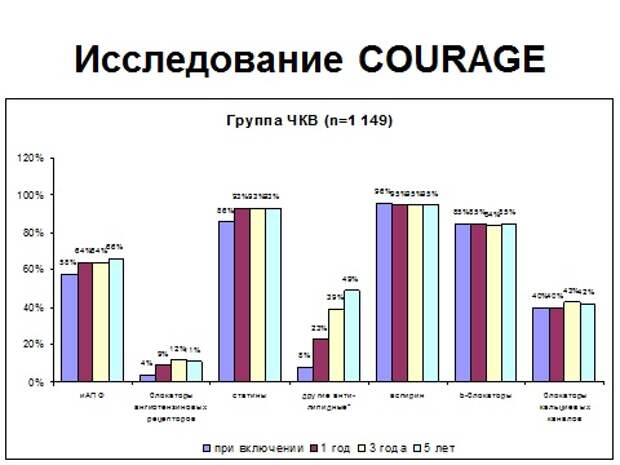
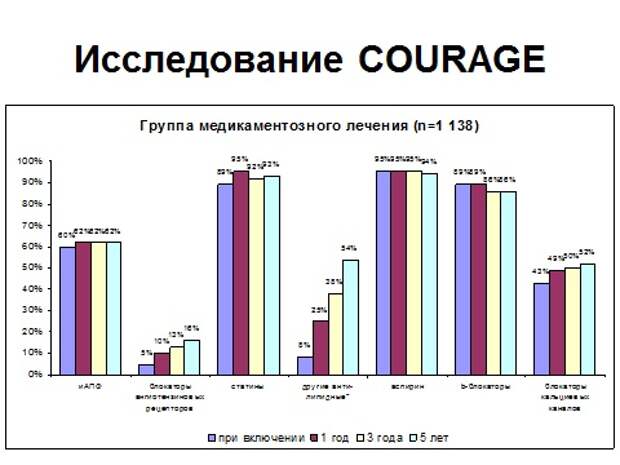
Итак, исследование, которое началось в 2000 году, это больные со стабильной стенокардией, с выраженным стенозом коронарной артерии, больше 75% с выраженной клиникой стенокардии, которые давно уже получали терапию АБС, это так называемая азбука кардиолога. Аспирин, бета-адреноблокатор, статин. Вы видите, что больные получали это лечение почти в 100%. Взяли группу, 2300 пациентов, и решили, посмотреть, какой плюс дает проведение ЧКВ и стентирования на фоне современной медикаментозной терапии. Для этого половине больных не стали делать ЧКВ, и стали смотреть, что получится.
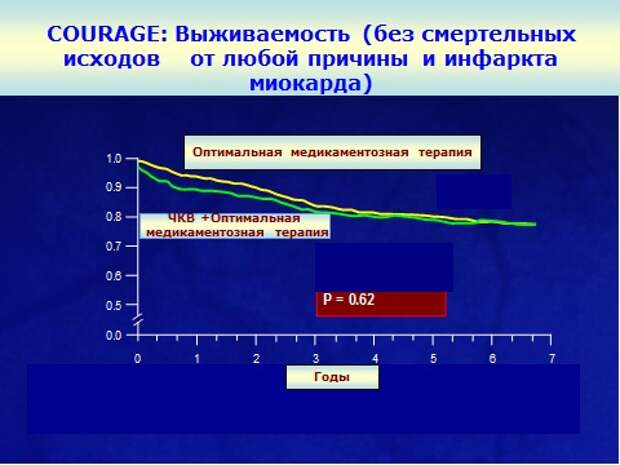
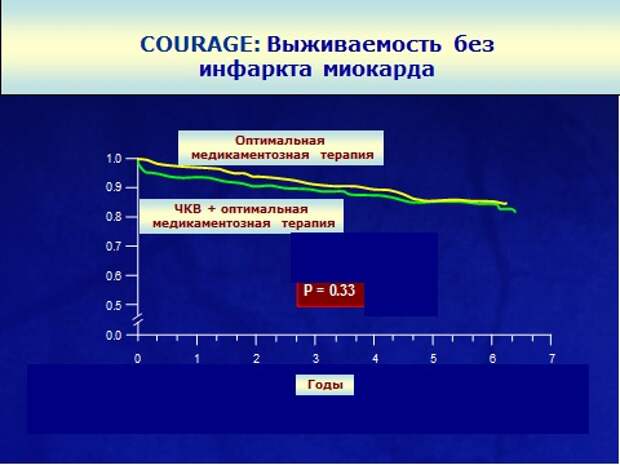
Вы видите, что все 5 лет и в группе стентирования, и в группе медикаментозного лечения совершенно одинаково все 5 лет получают свои препараты. Исследование длилось 7 лет. И что получается? Это так называемая кривая выживаемости, то есть сколько пациентов осталось без событий, вы видите, что они идентичны.
Делай стентирование - не делай стентирование, разницы никакой нет. Какой вывод из этого? У терапевтов – стентирование у больных со стабильной стенокардией бессмысленно: оно не улучшает прогноз. У хирургов – ставьте стенты, они помогают, потому что они улучшают толерантность к физической нагрузке, потому что поставили стент - и человек может больше ходить. Я согласен и с тем, и с другим доводом, что если больному нужно активно двигаться, и у него препятствие - ходьба, и он уже получает весь арсенал лекарственных препаратов, пусть ставит себе стент. Но если ко мне приходит больная, которая говорит: знаете, мне сделали коронарографию, у меня нашли стеноз где-то в одной из артерий, у меня, правда, стенокардии нет, все хорошо, надо ли мне ставить стент или вообще идти на какую-то операцию? Зачем? Какой смысл в этом? И вот мы 10 лет спокойно лечимся, несмотря на то, что каждый год ее вызывают и предлагают стентирование. То есть существует работа, которая отвечает на конкретно заданный вопрос: качество жизни или прогноз.
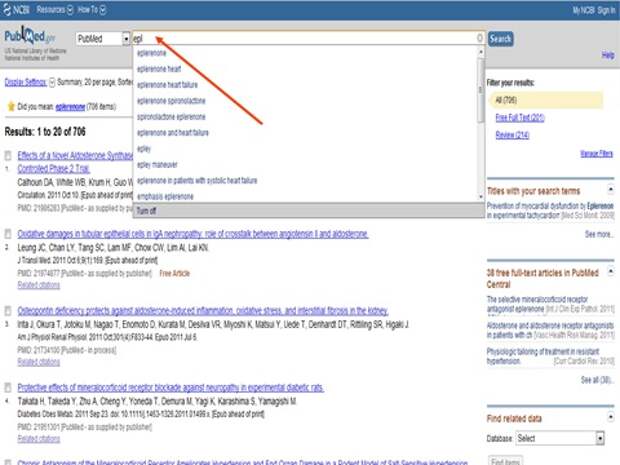
Ну и теперь я задаю себе и вам вопрос, а может ли врач или продвинутый пациент сам разобраться, что такое хорошо, а что такое плохо в современной медицине при лечении конкретного заболевания? Вот то, к чему я вас веду. Есть ресурс бесплатный, называется PubMed, любой человек может зайти. Вот, скажем, мне нужен препарат эплеренон, мне достаточно набрать первые три буквы, уже выскакивает слово, выскакивают все статьи, мне не нужны все статьи, я ставлю те, которые я могу взять в свободном доступе, я отмечаю trial, то есть контролируемые клинические исследования, и я могу спокойно прочитать все, что касается результатов исследований.
Вот это отношение шансов, что означает, что препарат на 37% улучшает прогноз, это сразу любой человек может прочитать, не надо разбираться во всей статье, во всей науке. Вот мне назначили эплеренон, он работает или нет? Открываешь, у меня был инфаркт, смотришь, что у всех больных, перенесших инфаркт миокарда, прогноз на 37% лучше, значит, надо пить. Иногда вопросы бывают тонкие, можно ли этот препарат во время беременности.
Вам открывается бесплатно журнал, я просто показываю возможности.
А если вы хотите уже более серьезно посмотреть сами исследования, тоже есть такие возможности. Есть специальный сайт, trialresultscenter.org, где зарегистрированы все исследования
Как можно искать исследование, которое вас интересует?
Например по акрониму...Может быть, вы услышали: я сказал «CAST», что это такое? Это название исследования. Вы хотите узнать, что реально было, какие цифры были. Хотите по препарату – идите по препарату, хотите по акрониму (названию исследования, например, CAST). Хотите по физиологии, то есть лечение гипертонии - опять же можно найти все
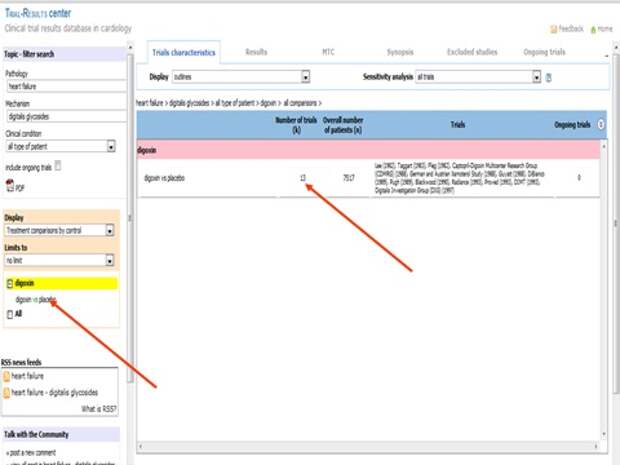
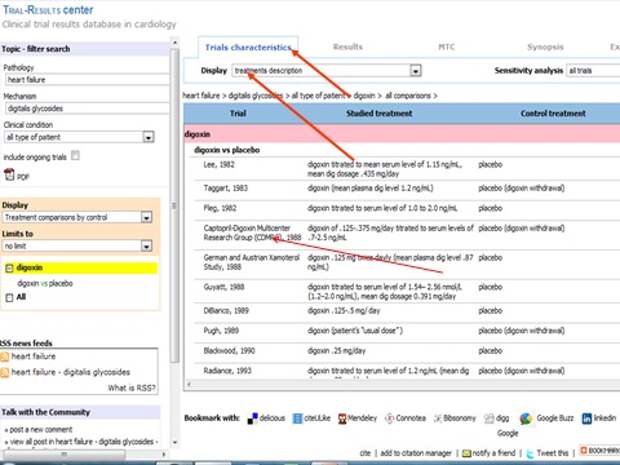
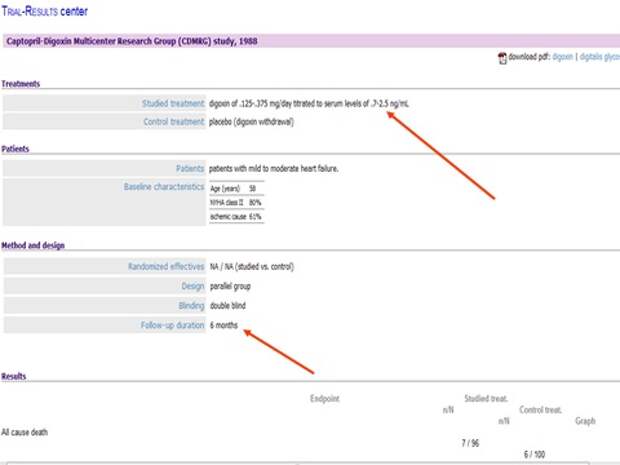
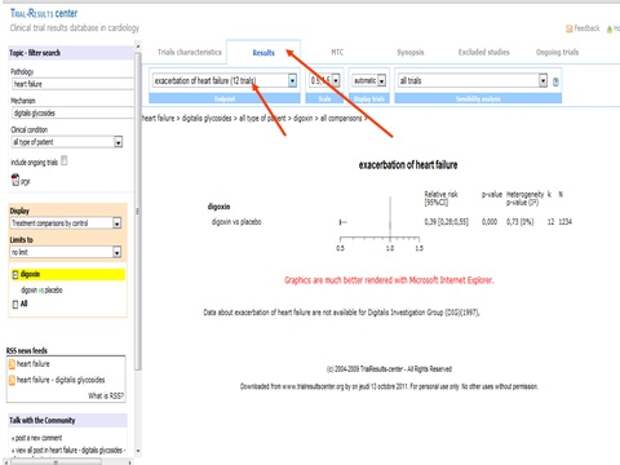
Меня интересует вопрос лечения дигоксином. Помните, я начал с того, что концепции лечения практически все поменялись? С введением доказательной медицины концепции лечения за 50 лет практически все поменялись. И одна из них, концепция, с которой я часто сталкиваюсь, - это возможность использования дигоксина у больных с сердечной недостаточностью. Когда я назначаю препарат, пациент часто говорит: я был у врача, он выписывал рецепт и сказал, что он запрещен, его нельзя назначать. Да, совершенно верно, так, как назначали в 60-х годах, категорически нельзя. Он отлично помогал, но смертность от него была очень высокая. Теперь надо назначать по другой схеме, не больше одной таблетки, и тогда все будет хорошо. Хотите, посмотрим исследование?
Давайте посмотрим там, где низкие дозы, то есть не больше одной таблетки.
И вы видите кучу исследований, и вот это доза в крови, и результат.
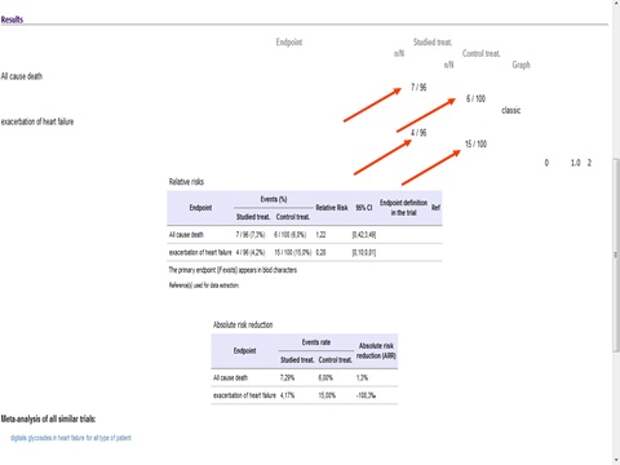
Если смотреть на повторные госпитализации, то на 61% повышает эффективность лечения. Но нас волнует смертность. Смертность чему равна? Единице, то есть не влияет.
Если вы даете дигоксин в низкой дозе, то не влияет. То есть эта программа позволяет просчитать все исследования, которые в ней хранятся, и провести свой анализ тех результатов, которые получены.
А теперь посмотрим, что было 50 лет назад. Вот метод быстрой дигитализации, тут 12 таблеток, здесь 5 таблеток одновременно. Лечил, и помогало! И был лучший доктор. Почему помогало? Я тоже так лечил в 80-х годах. Вот больной – у него одышка, он задыхается, даешь дигоксин, отеки уходят, печень нормализуется, он начинает ходить, все замечательно… только умирает. Но я-то этого не вижу! Он умирает где-то там, в поликлинике, у меня-то в стационаре все отлично, я его выписал в отличном состоянии. Если бы не проводили исследования, у меня так бы и оставалось бы мнение, что лучше не бывает. Я говорю о суррогатных и конечных точках. Это очень важно делить, поэтому то концепции и меняются.
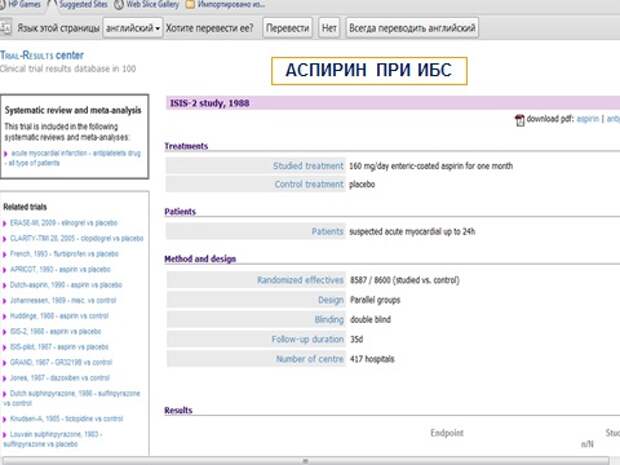
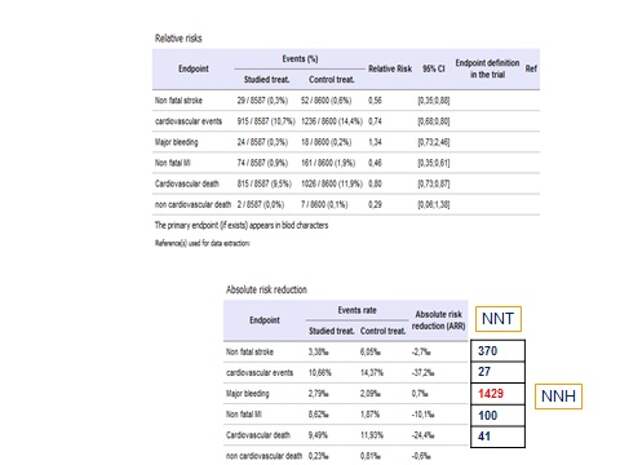
Аспирин при ИБС, вот это первое исследование ISIS-2, которое проложило путь к назначению аспирина при ИБС.
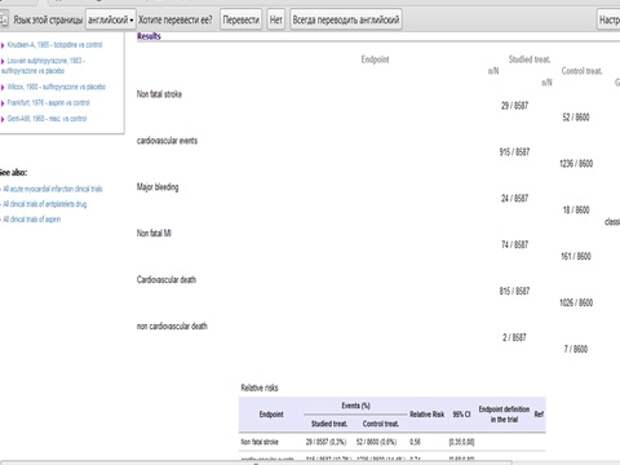
Здесь я пересчитал number needed to treat. Для того, чтобы не получить инсульт, надо пролечить 370 пациентов, чтобы не было кардиоваскулярного события любого – 27, отлично, а вот большое кровотечение – нужно пролечить 1429 пациентов, то есть если вы лечите 1429 пациентов, то у одного больного очень высокая вероятность, что случится большое язвенное кровотечение. А мы говорим профилактика – нужно пролечить 1000, чтобы спасти одного, то есть нецелесообразно. Мужчинам еще ничего, а женщинам – вообще бессмысленно, как показывают исследования аспирина по гендерному признаку.
Следующий тоже важный момент. Вот мы обсуждаем, что врачу надо рекомендации смотреть. Очень сильное исследование, называется ACCORD, на больных с сахарным диабетом. Идея – насколько строгий контроль глюкозы и строгий контроль давления лучше, чем средний контроль? Какой нижний порог контроля артериального давления лучше 120 или 140, а уровень глюкозы 7,5 или 6,5. Я не буду сейчас говорить про уровень глюкозы, мне это сейчас не интересно, я буду говорить про уровень давления, потому что сейчас на всех конгрессах говорят: «Как показало исследование Accord, мы забываем нашу старую тактику лечения».
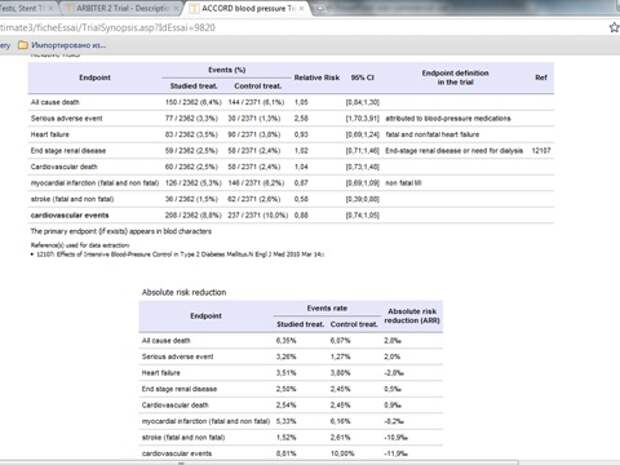
Давайте посмотрим результаты исследования, почему я призываю иногда заглядывать в источники. Я советую смотреть в само исследование, потому что оно дает гораздо более важную информацию. Почему так испугались эксперты? А вот почему: смотрите, эта величина, количество серьезных нежелательных эффектов в группе жесткого контроля, то есть там, где систолическое давление было ниже 120, среднее 119, было в 2,5 раза больше, чем в группе, где было 140. Поэтому, говорят, мы забываем контролировать давление до 120, оставляем где-то около 140, это нормально, говорят сейчас все европейцы. А давайте посмотрим на реальные вещи. А реальные цифры говорят о том, что инсульт, отношение шансов 0,58, то есть в группе строгого контроля, где давление очень строго контролируется, на 42% риск инсульта был ниже. И это было достоверно, потом что здесь доверительный интервал 0,39- 0,88, то есть единицу не пересекает. Дальше смотрим по другим твердым конечным точка -не достоверно, но и отношение риска не хуже. Какое я принимаю решение относительно этих выводов? На самом деле, не все так страшно, только надо очень четко ориентироваться на состояние больного. Если больной говорит, вы ему спустили артериальное давление до 140, а у него слабость появилась, пошатывает, одышка появилась, не надо дальше снижать, пусть адаптируется к этим цифрам. А если мне пациент говорит, «что вы меня держите на 140? У меня 120 – замечательное давление, я себя прекрасно чувствую, а когда у меня 128-135, у меня уже голова начинает болеть». Конечно, спокойно он может лечиться в жестком режиме.
Индивидуальный подход. То есть мы смотрим на фактуру и при этом начинаем понимать, как мы можем работать с больным. Еще одно очень важное исследование, и я буду заканчивать.
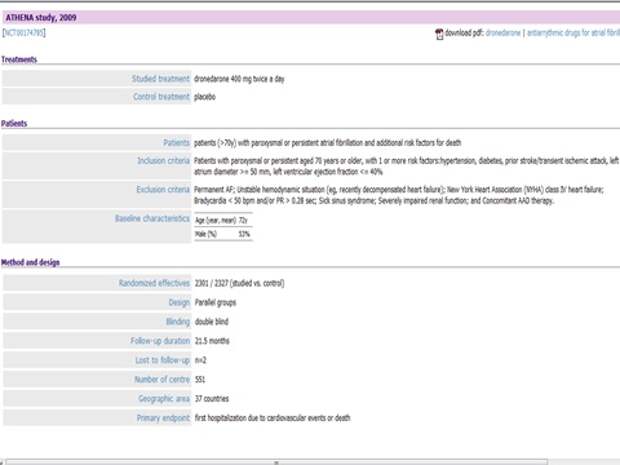
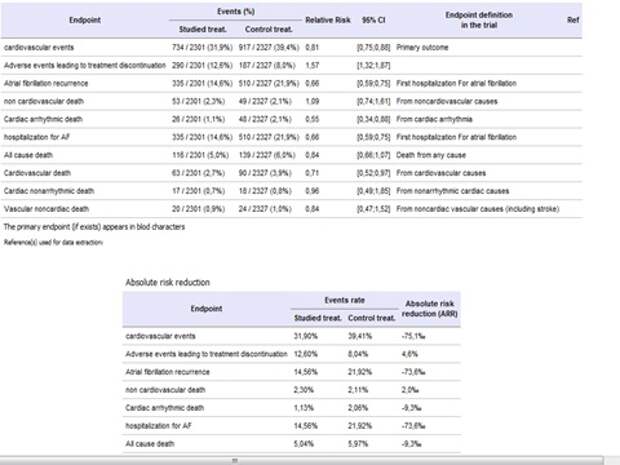
Дронедарон, новый препарат, антиаритмик, другого класса, не то, что обсуждали ранее 1С класса, это третий класс. Пришел на смену кордарона, кордарон – прекрасный препарат, используется для лечения мерцательной аритмии. Особенность дронедарона в том, что он не содержит йод, которым обусловлены побочные эффекты кордарона. Итак, появился новый препарат. Используют для профилактики фибрилляции предсердий, то есть у больного периодически на фоне нормального ритма возникают приступы аритмии.
Результат замечательный - на 45% снижает появление аритмии, улучшает показатели состояния больного и т.д. Вывод – лечим. Во всех журналах, на всех симпозиумах говорят: лечите только дронедароном.
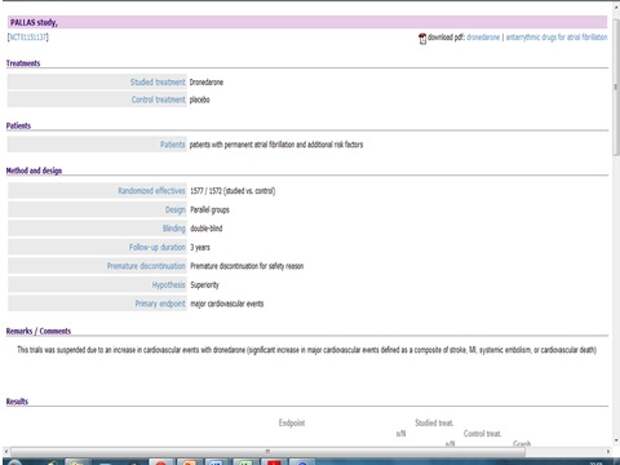
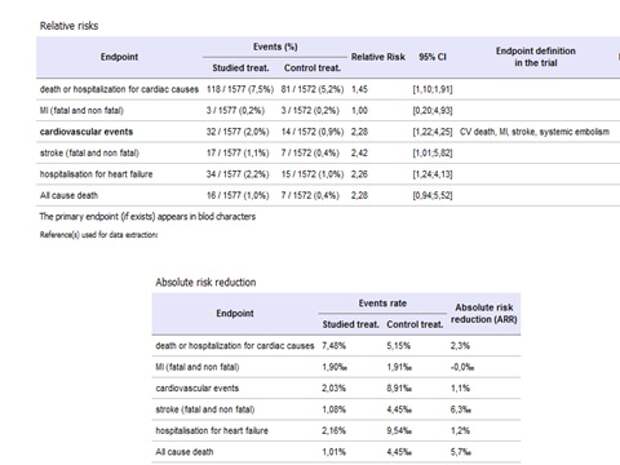
Но провели другое исследование, назначили этот препарат больным с постоянной формой мерцательной аритмии, - и получили, что смертность или количество событий было в 2 раза больше, чем там, где этого препарата не было. Вывод? Статьи с результатами этого исследования нигде нет, об этом никто не говорил, но это знание есть. То есть назначать такой препарат просто больному с мерцательной аритмиейнельзя. Сегодня я отчитывал доктора, который назначил кордарон с постоянной формой мерцательной аритмии.
Итак, подходим к важному вопросу, который был задан перед лекцией. Доказательная медицина пришла и заменила, стерла все, что было до того? Это что-то новое, и мы должны все отбросить, что было раньше? Или это просто инструмент врача? Это инструмент. Я скажу главный вывод - это инструмент уверенности в своих действиях. Как моего, как врача, так и пациента, что его лечат правильно. Потому что до этого все было на уровне благих намерений.
Следующее, врачу надо ли проводить эти испытания, чтобы понять, работает препарат или нет? Не надо, это бессмысленно, он никогда это не поймет. Врачу надо читать результаты, что, к сожалению… Нужно ли их принимать рекомендации абсолютно к действию? Нет, потому что вы врач, вы знаете разные подходы, вы знаете нюансы, у вас в столярной мастерской лежит куча инструментов, но для каждой работы над каждым материалом вы выбираете свой, хотя понятно, что каждый из них делает примерно одну и ту же работу. Не надо брать то, что явно не подходит, для тонкой работы не надо брать грубый топор. Это что значит? Если доказан вред, то использовать точно нельзя. В этом врач должен быть абсолютно уверен.
Теперь, в заключение, скажу: постоянно эксплуатируется тема доказательной медицины - сейчас это стало сверхмодно. Все говорят: «…как показала доказательная медицина…». На что надо смотреть? Как проводилось исследование, сколько больных было рандомизировано, было ли оно плацебо-контролируемое. Если я вижу 20 больных в группе, а потом они пишут рекомендации по лечению неврологических больных… Теперь ваши вопросы. (продолжение во второй части)
Оригинал текста: http://polit.ru/article/2013/09/13/parnes/